关于硬件
1.购买的Balb/c小鼠种系要纯正,来源可靠,不要为了省钱自养自繁(有老鼠自繁生产能力单位除外)。
2017年11月13日《自然》新闻报导:2016年某小鼠供应商发现,在其全球19个养殖基地中,有6个基地的C57BL/6小鼠基因发生改变(有兴趣的读者可以查阅一下这个文章);由此我们可推理,现在所使用的Balb/c小鼠也有可能发生基因突变。
2.SP2/0细胞要纯正,既然老鼠的基因可以发生改变,那么SP2/0细胞整天被我们传来传去,并且不知道传了多少代。
很多实验者对于养细胞不是很熟练,对于细胞状态的观察也没有经验,有时候细胞养过了头(培养基黄黄的,部分细胞脱落),使用了不合适的培养基(最要命的是不合格的培养基)和培养方法,细胞养得半死不活,你说这样的细胞能做好单抗吗?
还有就是不能有污染(隐性污染和显性污染)。
3.牛血清和培养基要可靠。
牛血清对于细胞培养的支持至关重要,市面上的牛血清品牌多,五花八门,很多实验者迷信某某品牌或者高价血清,其实具体的细胞融合实验效果还得靠亲自实验得来。
血清最重要的就是不能有污染(隐性污染和显性污染),血清中常见的污染是支原体以及业界所传说的“黑胶虫”的“显性污染”。
4.二氧化碳培养箱。
细胞的培养一般需要5%的CO2来支撑培养液的缓冲体系,如果CO2浓度不准确的话,会严重影响细胞培养液的PH值,影响细胞生长状态(这个一般很少人关注)。
托盘里面的水如果水太少,细胞培养板里面培养基的水分会快速蒸发以至于干涸;托盘水里要加入抑菌之类试剂。
5.超净台以及耗材。
很多实验室的超净台长期不清理,或者多人使用,很难保证其清洁度;甚至有很多实验室超净台超期没及时检测、清洗或者更换滤膜,存在潜在污染的可能。
虽然,培养液里加了双抗(青霉素-链霉素),但是这个不是万能的,一般对于显性污染(细菌污染和真菌污染)比较容易发现,隐形污染往往被忽略,当实验不顺利时,苦于找不到症结所在。
所使用的耗材特别是直接跟细胞或者培养基接触的耗材一定要无菌清洁(不含有细胞毒性物质),如果有条件的实验室可以采用一次性质量好的耗材,如果自己清洗灭菌的话一定要保证所使用的清洗用的去离子水合格,清洗操作合格到位。
细胞培养板也有讲究,有些细胞培养板对细胞并不友好。
6.其他试剂(HAT/HT/PEG/DMSO……)。
使用细胞培养级别的,使用细胞培养级别的,使用细胞培养级别的……
以上简单罗列六类主要“硬件”,千万不要贪图便宜或者盲目信任权威“血清”,融合一次不成功所浪费的其他物料成本已经远远超过您想节约的“成本”,这里还没有计算老鼠免疫抗原浪费,时间浪费以及人工费用。
解决办法:
对于普通的科研实验室,不可能有那么多的时间、精力和经验去测试每一个试剂耗材,最好的办法是找可以找专业单抗公司,跟他们商量一下,从他们批量采购的试剂耗材中“撬一点”。
为此,福因德科技专门配置了一个”单抗制备融合无忧套装”,可保证您轻松完成细胞融合,得到细胞集落。
套装内容主要包括:培养基/融合专用血清/融合剂/SP2/0细胞/HAT & HT/细胞培养板,可以保证完成两次完美融合。
关于软件
最核心的软件就是人,科学实验在理解每个步骤原理的情况下,胆大心细,适可而止。
7.实验基本功
7.1细胞培养技术
SP2/0细胞和杂交瘤细胞是非常容易培养的,如果实验者发现细胞老是长不好,在以上“硬件条件”具备的前提下,基本上是细胞培养技术的问题。实验者经常希望小福一口可以告诉他为什么她的细胞养不好,小福做不到,这是一个很复杂的问题,每个环节都可能有问题;小福在帮助排除每个环节的时候,实验者斩钉截铁地说没有问题,最后小福都憋出内伤。
7.2免疫检测技术
单抗的检测主要方法还是免疫检测技术,常用的ELISA、Western Blot、IHC、IF等等,这些基本功都是需要修炼的,绝不是水到渠成。
8.实验方法设计
单克隆抗体实验的核心是检测筛选方法,在细胞融合前就应该把检测筛选方案设计并把实验优化好,检测实验方法要有效、稳定且易于实施。
单抗的初步检测筛选一般先用间接ELISA,因为间接ELISA最易于大规模实施,间接ELISA检测为阳性孔再进一步作其他实验筛选。
案例:
福因德科技技术人员曾经设计一个可以用于快速筛选“双抗体夹心法检测抗原”用途的捕捉抗体(Capture Antibody) ,设计这样的方案如下图,信心满满,踌躇满志。
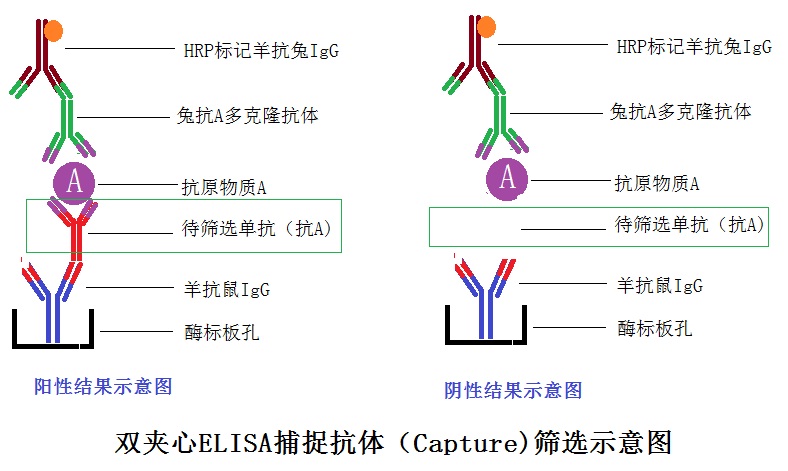
结果做下来,满板子一片蓝。
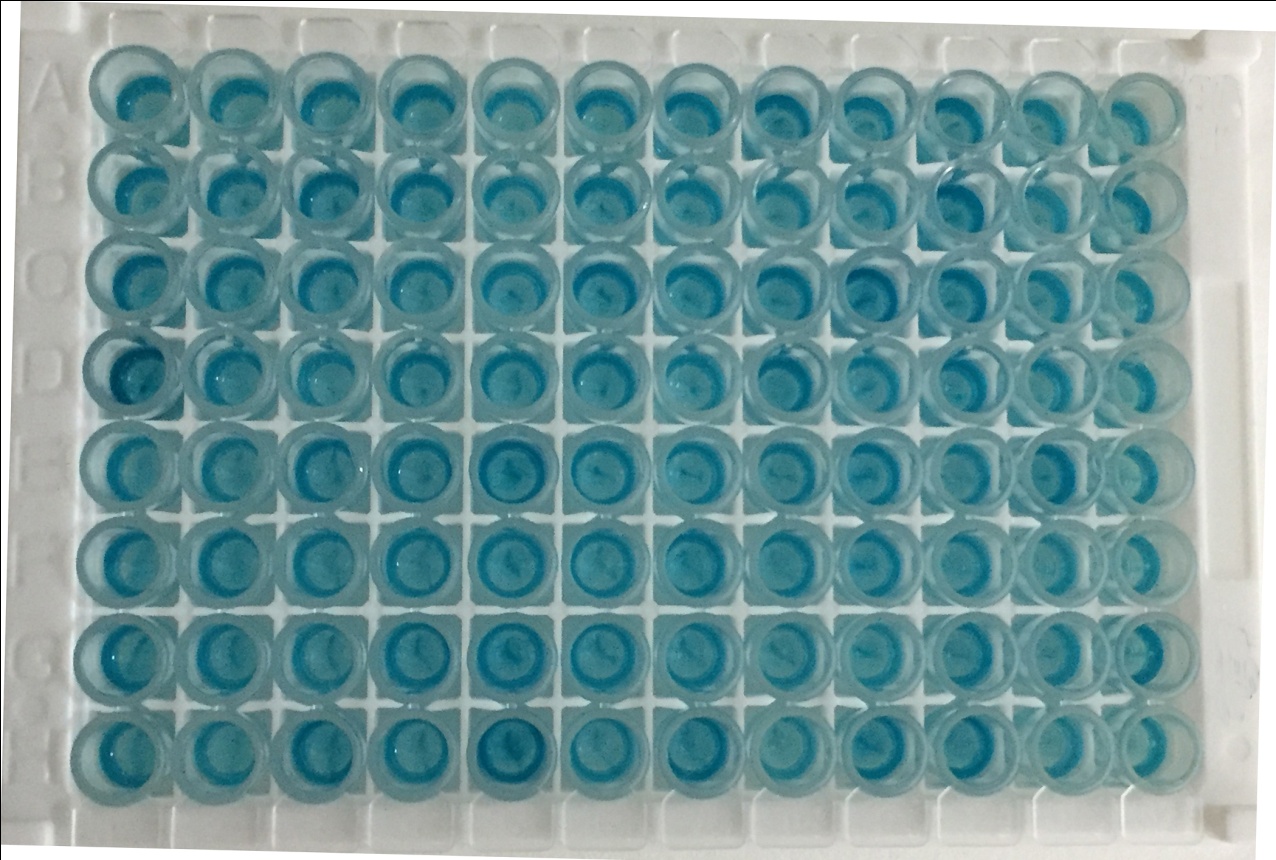
我们返回去找原因,发现空白对照(不加待筛选单抗的细胞培养液上清)也是蓝色的,这个筛选检测实验显然是无效的,上述实验中涉及到两个二抗(一个是包被在酶标板上的羊抗小鼠二抗,一个是羊抗兔HRP标记二抗),任何一个二抗出现非特异性结合问题,整个实验体系都会出现“短路”,造成上图结果。
以上只是举一个例子,类似的尴尬不胜枚举。此时细胞不停在长,如果没有有效的检测筛选方法,只能眼睁睁看着细胞丢弃。
独门秘技
9.免疫佐剂
我们习惯于弗氏佐剂,如果某个单抗作了很多次始终搞不出来,不妨试试其他佐剂;福因德开发出多款新型佐剂,如水溶性佐剂和纳米佐剂。细胞因子类或者活性蛋白类针对抗体构象表位的很多单抗大部分都是这两个佐剂的功劳。
10.冲击免疫技巧
对于难度比较大的单抗项目,还是要在冲击免疫上做文章,腹腔冲击免疫效果远不如尾静脉免疫和脾脏免疫(需要具体实验步骤请联系微信linkbio)
11.高通量检测
间接ELISA的高通量筛选最为容易,其他实验的开展。
12.关于亚克隆
12.1 亚隆宜早不宜晚
初步检测筛选一般进行两次,检测到阳性孔之后,补液次日再次检测确认,这样避免假阳性(未融合的脾细胞分泌的抗体残留在孔)。
检测筛选到阳性孔后尽快进行亚克隆,避免非相关细胞“喧宾夺主”占据优势后,阳性细胞株丢失;如果一个细胞孔有多个集落,有条件的可以将每个集落分别挑取简单培养后再作亚克隆;亚克隆时,细胞孔的所有细胞都要吹打悬浮起来,计数要准确,确保计数的细胞悬液与准备亚克隆的一致;细胞操作时间不宜过长。
12.2有限稀释
有限稀释法就是将细胞稀释到平均每孔几个细胞,根据“泊松分布”表,可以查到具体的每孔没有细胞的概率是多少,分种1个细胞概率是多少,分种2个细胞的概率是多少。。。。。。。这是标准意义上的“泊松分布”,由于操作误差、细胞在吹打过程受到剪切力、培养基承载细胞生长能力等等原因,标准的“泊松分布”分布表可能并不实用。教科书说如果按照每孔0.8个细胞计算,每孔分到1个单细胞的几率最高。这个是理想状态, “泊松分布”在不同实验室是需要修正的,小实验室最佳亚克平均数为1.1。
12.3腹水生产
腹水生产,往往遇到的问题是不产腹水,腹水产量少和血性腹水问题。这些问题解决起来也不棘手。
选择肚子的大的经产母鼠,注射细胞之前3-5天腹腔注射0.5-1.0ml的弗氏不完全佐剂,细胞注射量为105个细胞/只;
为避免动物的个体差异问题,每个细胞注射2-3只老鼠;
对于死活不产腹水的细胞株,可以试试Frdbio腹水超强诱导剂(货号MAC0089)。
本文版权归福因德科技所有,任何转载需要经过作者授权。